抗体药物偶联物在恶性肿瘤领域的临床应用
普健生物 http://kx.atagenix.cn/ 2024-01-02
抗体药物偶联物(ADC)是一类通过连接子将细胞毒性药物连接到单克隆抗体的靶向生物制剂,可高效靶向转运至目标肿瘤细胞而发挥抗肿瘤作用
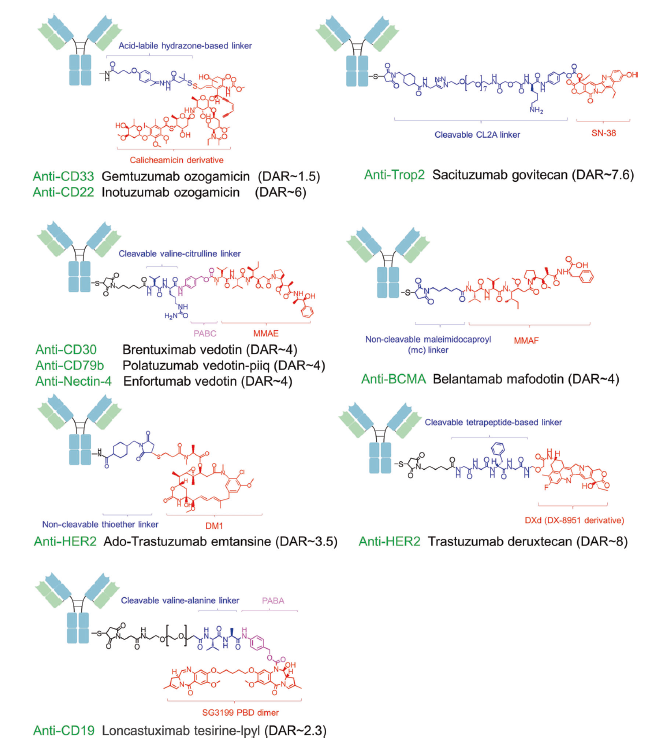
抗体药物偶联物(antibody-drug conjugate, ADC)是一类通过连接子将细胞毒性药物连接到单克隆抗体的靶向生物制剂,将单克隆抗体作为载体将小分子细胞毒性药物以靶向的方式高效地运输至目标肿瘤细胞中。肿瘤特异性抗体使ADC药物可以选择性递送小分子细胞毒性药物,在减少小分子细胞毒性药物脱靶作用的同时,保留了其抗肿瘤特性,有效地提高了抗肿瘤治疗的效益风险比。因此,近年来ADC药物一直是肿瘤精准治疗领域的热门研究方向之一。截至2022年9月30日,已有14种ADC药物在全球范围内获批用于临床(包括血液系统肿瘤和实体瘤领域),其中,美国获批12种,欧盟获批10种,我国获批4种,日本获批4种(表1 )。此外还有百余种ADC药物的临床研究正在开展中。
| 药物名称 | 靶点 | 细胞毒性药物 | 适应证 | 获得批准情况 |
| 吉妥珠单抗 | CD33 | 刺孢霉素 | CD33阳性急性髓性白血病 | 2000年获得批准,2010年撤销上市,2017年于美国重新获得批准,2018年于欧盟获得批准 |
| 维布妥昔单抗 | CD30 | 甲基澳瑞他汀E | 经典型霍奇金淋巴瘤,系统性间变性大细胞淋巴瘤或CD30阳性外周T细胞淋巴瘤,原发CD30阳性皮肤间变性大细胞淋巴瘤或CD30阳性的蕈样肉芽肿 | 2011年于美国获得批准,2012年于欧盟获得批准,2020年于中国获得批准 |
| 恩美曲妥珠单抗 | HER-2 | 美坦辛衍生物 | (1)HER-2阳性晚期乳腺癌:用于既往接受过曲妥珠单抗和紫杉类药物单独或联合治疗,并满足以下条件之一:既往接受过针对转移性疾病治疗;在辅助治疗期间复发;完成辅助治疗后6个月内出现复发;(2)HER-2阳性早期乳腺癌:用于在基于紫杉类药物和曲妥珠单抗的新辅助治疗后残留浸润性病灶患者的辅助治疗 | 2013年于美国获得批准,2013年于欧盟获得批准,2013年于日本获得批准,2021年于中国获得批准,2019年于美国获得批准,2020年于中国获得批准 |
| 奥英妥珠单抗 | CD22 | 刺孢霉素 | 成人复发或难治性CD22阳性前体B细胞急性淋巴细胞白血病 | 2017年于美国获得批准 |
| Polatuzumab vedotin | CD79b | 甲基澳瑞他汀E | 联合苯达莫司汀和利妥昔单抗治疗复发或难治性弥漫大B细胞淋巴瘤 | 2019年于美国获得批准 |
| Enfortumab vedotin | Nectin-4 | 甲基澳瑞他汀E | (1)既往接受过PD-1或PD-L1抑制剂和含铂化疗的局部晚期或转移性尿路上皮癌;(2)不适合顺铂治疗且既往接受过一线或多线治疗的局部晚期或转移性尿路上皮癌;(3)既往接受过PD-1或PD-L1抑制剂治疗且不适合顺铂治疗的局部晚期或转移性尿路上皮癌 | 2019年于美国获得批准,2021年于日本获得批准,2021年于美国获得批准,2022年于欧盟获得批准 |
| Trastuzumab deruxtecan | HER-2 | Exatecan衍生物 | (1)用于治疗接受过2种或2种以上抗HER-2治疗方案的无法切除或转移性HER-2阳性乳腺癌成年患者;(2)用于既往在转移阶段接受过至少1种抗HER-2治疗方案或在接受抗HER-2新辅助或辅助疗法期间以及之后6个月内出现疾病复发的不可切除或转移性HER-2阳性乳腺癌成人患者;(3)用于治疗既往在转移阶段接受过治疗的不可切除或转移性HER-2低表达(IHC 1+或IHC 2+/ISH-)成人乳腺癌患者;(4)已接受过曲妥珠单抗治疗的局部晚期或转移性HER-2阳性胃或胃食管交界腺癌患者;(5)用于治疗既往接受过全身治疗的HER-2敏感突变的不可切除或转移性非小细胞肺癌成人患者;(6)用于治疗化疗进展的不可手术晚期或复发性HER-2阳性胃癌患者 | 2019年于美国获得批准,2020年于日本获得批准,2021年于欧盟获得批准,2022年于美国获得批准,2022年于欧盟获得批准,2022年于美国获得批准,2023年于中国获得批准,2021年于美国获得批准,2022年于美国获得批准,2022年于欧盟获得批准 |
| 戈沙妥珠单抗 | TROP-2 | SN-38,伊立替康的活性代谢产物 | (1)用于既往至少接受过2种系统治疗(其中至少1种治疗针对转移性疾病)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者;(2)接受过含铂化疗和PD-(L)1抑制剂治疗的局部晚期或转移性尿路上皮癌成年患者;(3)用于既往接受过内分泌治疗且≥2线系统治疗(针对转移性疾病)的HR阳性、HER-2阴性的不可切除的局部晚期或转移性乳腺癌患者 | 2020年于美国获得批准,2021年于欧盟获得批准,2022年于中国获得批准,2021年于美国获得批准,2023年于美国获得批准 |
| Moxetumomab pasudotox | CD22 | PE38 | 成人复发或难治性毛细胞白血病,既往接受过至少二线治疗 | 2018年于美国获得批准 |
| Belantamab mafodotin | BCMA | 甲基澳瑞他汀F | 用于治疗既往已接受过至少4种疗法(包括抗CD38单抗、蛋白酶体抑制剂和免疫调节剂)的复发或难治性多发性骨髓瘤成人患者 | 2020年于美国获得批准,2020年于欧盟获得批准 |
| Cetuximab sarotalocan | EGFR | IRDye700DX | 不可切除的局部晚期或复发性头颈癌 | 2020年日本获得批准 |
| Loncastuximab tesirine | CD19 | PBD | 治疗已接受过至少2种系统疗法的复发或难治性大B细胞淋巴瘤成人患者,包括弥漫性大B细胞淋巴瘤、低级别B淋巴瘤转化的大B细胞淋巴瘤和高级别B细胞淋巴瘤 | 2021年于美国获得批准 |
| 维迪西妥单抗 | HER-2 | 甲基澳瑞他汀E | (1)用于至少接受过2种系统化疗的HER-2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗;(2)用于既往接受过含铂化疗且HER-2过表达即免疫组化检查结果为HER-2 2+或3+的局部晚期或转移性尿路上皮癌 | 2021年于中国获得批准,2022年于中国获得批准 |
| Tisotumab vedotin | TF-011 | 甲基澳瑞他汀E | 用于在化疗期间或化疗后出现疾病进展的复发或转移性成人宫颈癌患者 | 2021年于美国获得批准 |
ADC药物定义
ADC药物是一类通过特定的连接子将特异性的单克隆抗体与高杀伤性的细胞毒性药物偶联起来的靶向生物制剂。ADC药物通常应包含以下3个组分:高特异性和亲和力的抗体,高稳定性的连接子,高效的小分子细胞毒药物。
ADC药物临床应用
ADC药物是一类具有独特作用机制的抗肿瘤创新药,既往的临床数据显示ADC药物在肿瘤治疗中具有很好的疗效和安全性,本共识旨在推进ADC药物的临床应用规范和安全,让更多的肿瘤患者获益。
多学科管理
ADC药物的不良反应取决于非肿瘤组织靶标的生理功能和表达情况、连接子的性质、细胞毒性药物的数量和类型等多种因素。因此,针对每种ADC药物应密切关注特异性的不良反应,并给予对症处理,必要时应邀请相关学科专家会诊,降低不良反应对患者预后和生活质量的影响。
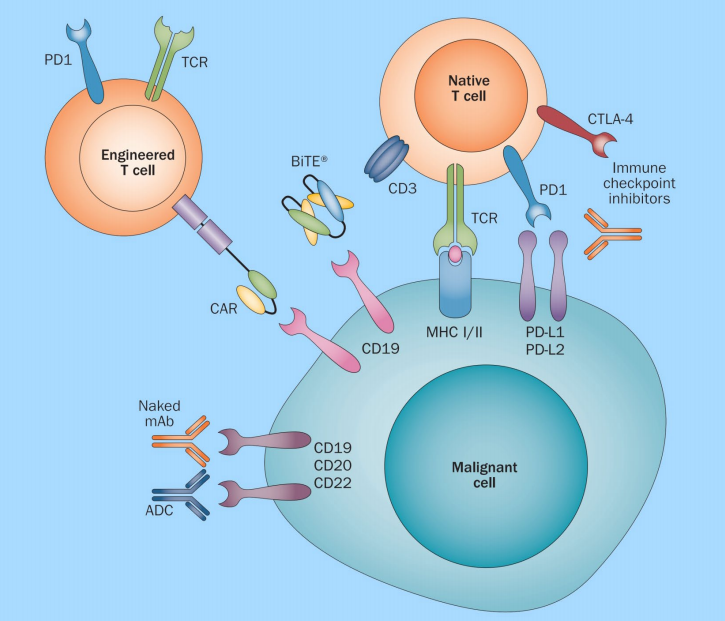
随着抗体工程技术的不断优化,各种新型治疗性抗体药物相继用于癌症的治疗,包括抗体偶联药物(ADC)、双特异性/多特异性抗体、免疫细胞因子、抗体片段(例如Fabs、scFvs和VHH结构域)和非IgG支架蛋白。目前,经批准的ADC药物的靶抗原通常是在癌细胞中过表达的特异性蛋白,包括实体瘤中的HER2、trop2、nectin4和EGFR,以及血液恶性肿瘤中的CD19、CD22、CD33、CD30、BCMA和CD79b。在肿瘤学和免疫学基础研究的推动下,ADC靶抗原的选择逐渐从传统的肿瘤细胞抗原扩展到肿瘤微环境中的靶点,例如基质和脉管系统。临床前和临床研究不断涌现出的新证据表明,新生血管系统、内皮下细胞外基质和肿瘤基质的成分可能是ADC药物开发的有价值的靶抗原。
在ADC药物的开发中需要面临很多挑战,例如抗体药物的发现与筛选、药物的有效性、与ADC药物相关的毒性等。普健生物作为武汉国家生物产业基地指定的唯一光谷抗体发现与筛选公共服务平台,在蛋白抗体领域拥有超过15年的技术经验积累,基于完善的五大蛋白表达系统和三大核心技术路线,能提供从抗原制备,到抗体生产,标记,检测,测序一站式服务,加速抗体药物研发进程。