临床与新药研发综述:常用CDI药物耐药机制的研究进展
普健生物 http://kx.atagenix.cn/ 2024-03-14
抗微生物药物耐药(antimicirobial resistance,AMR)是全球公共卫生面临的重要威胁。艰难梭菌(Clostridioides difficile,CD)是一种重要的多重耐药菌,常对大环内酯类、林可酰胺类、四环素类、头孢菌素类和氟喹诺酮类呈多重耐药。该特征使得CD能够在应用广谱抗菌药物导致肠道菌群失调时进行优势生长、产生毒素从而造成艰难梭菌感染(Clostridioides difficile infection,CDI),同时其产芽孢的特性可造成CD在医疗机构内的广泛传播。从2013年开始,CD就被被美国疾病控制和预防中心(Centers for Disease Control and Prevention,CDC)列为最紧迫的公共卫生威胁,每年给美国医疗保健系统造成10亿美元的损失。至2019年美国CDC仍将其纳入五大抗生素耐药性紧急威胁之一。
当前临床上推荐治疗CDI的抗菌药物有甲硝唑(metronidazole,MTZ)、万古霉素(vancomycin)
和非达霉素(fidaxomicin)。除此之外,有研究表明替加环素(tigecycline)可有效治疗重度CDI,利福昔明(rifaximin)可能有助于预防CDI复发。然而,近年来发现CD对这些药物的敏感性较前下降。来自美国休斯顿的一项研究结果显示CDI患者粪便分离株中26%对万古霉素不敏感,29%对MTZ不敏感;而在肯尼亚内罗毕进行的另外一项研究显示对二者不敏感的分离株比例可高达67%和85%。与此同时,这两种药物治疗失败的报道也并不少见。在国内,艰难梭菌不属于CARSS和CHINET细菌耐药监测网监测病原菌范畴,但某些小规模流行病学研究仍然提示耐药菌株的存在。Meta分析显示2007~2013年间我国临床来源艰难梭菌对利福平的耐药率为18.3%,对四环素的耐药率为46.8%,对甲硝唑和万古霉素则完全敏感。浙江杭州两所三甲医院2012~2015年间腹泻患者粪便l来源的411株艰难梭中有15.6%对甲硝唑耐药,36.3%对四环素耐药,所有菌株均对万古霉素敏感,且产毒株的多重耐药率(96.4%)远高于非产毒菌株(31.4%)。艰难梭菌对抗菌药物耐药机制是多种多样的。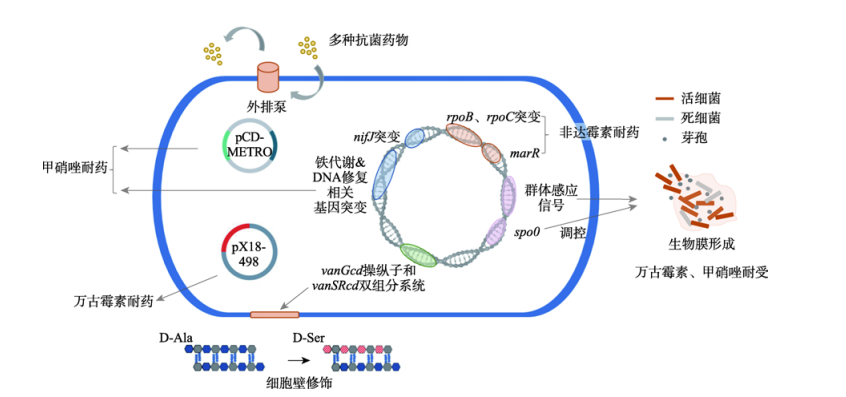
艰难梭菌对临床常用CDI治疗抗菌药物的耐药机制
细菌对抗菌药物主要的几类耐药机制在艰难梭菌中均比较常见。艰难梭菌可通过改变药物结构造成抗菌药物失效:例如通过转座子Tn4453a和Tn4453b上携带的catD编码的氯霉素乙酰转移酶,对氯霉素伯羟基进行乙酰化修饰导致药物失效无法与细菌50S核糖体亚基结合;此外某些CD菌株编码D类β-内酰胺酶可破坏β-内酰胺环使头孢菌素类药物失去活性。艰难梭菌还可对抗菌药物靶点进行修饰:例如vanCd操纵子的表达可造成CD肽聚糖前体末端d-Ser修饰,使该位点与万古霉素的亲和力降低。迄今为止,在CD临床株RpoB利福平耐药决定区(rifampin resistance determining region,RRDR)中也已发现十余种耐药突变,可能阻碍利福霉素类药物与靶点RpoB蛋白的结合。艰难梭菌编码不同家族的转运蛋白对抗菌药物进行主动外排:例如CD中cdeA编码的MATE家族转运蛋白与氟喹诺酮耐药有关,而ABC家族转运蛋白CprABC介导了CD对抗微生物肽的抗耐药性。生物膜的形成同样参与了艰难梭菌对药物的耐受:亚抑菌浓度的万古霉素和甲硝唑可增强CD生物膜的形成,同时CD生物膜又可耐受更高浓度的甲硝唑(10~100mg/L)和万古霉素(20mg/L)。除此之外,一些既往未考虑的机制如可转移质粒介导的耐药(推测编码N-乙酰胞壁酰-L-丙氨酸酰胺酶的万古霉素耐药质粒pX18-498,甲硝唑耐药质粒pCD-METRO等),同样可能在艰难梭菌AMR中发挥重要作用。
甲硝唑
MTZ是硝基咪唑类抗生素,自20世纪90年代末以来一直是治疗轻中度CDI的首选药物。然而,自从流行毒株NAP1/027出现后,许多国家陆续报道了对MTZ低水平耐药和异质性耐药的菌株,近年来甚至分离到高水平耐药株。对MTZ治疗响应降低的CDI病例报道也越来越多见。
MTZ是一种前体药物,摄入菌体后,在胞内经厌氧菌特有的低氧化还原电位酶促反应还原激活,杂环裂变后形成羟乙基肟酸和乙酰胺。MTZ的杀菌机制尚不明确,可能为活化反应伴随生成的硝基自由基对厌氧菌产生细菌毒性,造成细菌死亡。
CD对MTZ耐药亦可能涉及多种机制,其一是药物还原激活通路的改变。参与药物氧化还原反应的电子传递蛋白如丙酮酸黄多辛氧化还原酶PFOR等在该酶促反应中发挥了重要作用,这类蛋白编码基因的突变参与了耐药形成。铁离子作为组成PFOR等电子传递蛋白功能性
辅基(如含铁硫簇)的重要元素,在MTZ还原激活途径中发挥重要作用,因此铁代谢/稳态的变化也被认为与CD对MTZ耐药有关。
艰难梭菌对甲硝唑耐药可能与甲硝唑的临床疗效下降有关。近期研究表明,艰难梭菌对MTZ MIC≥1μg/mL是基于MTZ的初始治疗方案临床治疗失败的独立预测因素。来自美国与欧洲的两个多中心队列RCT研显示甲硝唑标准方案下CDI初始治疗失败率接近30%,且后续出现CDI复发的概率总体达到23%,两项指标均劣于万古霉素。因此近5年欧洲和美国指南中MTZ地位有所下降,仅推荐用于治疗不能耐受或无法获得万古霉素/非达霉素的轻中度CDI初次发作患者。
万古霉素
最常见的万古霉素耐药机制是van基因介导的药物靶点修饰,造成万古霉素与细胞壁亲和力降低。van系列基因主要介导d-Lac或d-Ser两种末端修饰。其中,d-Lac修饰(d-Ala-d-Lac)由vanA和vanB基因簇编码,可造成高水平万古霉素抗性;d-Ser修饰(d-Ala-d-Ser)由vanC、vanE和vanG基因簇编码,可造成低水平抗性。多药外排泵是存在于细菌细胞膜中的主动转运蛋白,其中一个主要家族是ATP结合盒(ATPbinding cassette,ABC)转运蛋白,水解ATP供能,对简单离子或大分子的溶质如抗菌药物进行转运外排。已有研究在几种梭状芽孢杆菌中证实转运蛋白是造成多药耐药的主要原因。在CD中,阳离子抗菌肽(cathelicidin antimicrobial peptide,CAMP)可诱导ABC转运蛋白操纵子高表达,从而降低各种CAMP的有效性。
非达霉素
窄谱抗菌药物非达霉素与细菌RNA聚合酶(RNA polymerase,RNAP)的夹型结构域结合,抑制DNA转录的起始步骤。自2011年起,美国食品药品监督管理局批准非达霉素用于CDI。
非达霉素耐药性源于RNAP结合位点的突变,包括RpoB (Gln1074Lys,Val1143Asp、Gly、Phe)和 RpoC(Gln781Arg,Asp1127Glu,Asp237Tyr)等多种突变。其中,Val1143Asp (MIC>64 mg/L) 和Val1143Gly (MIC=16 mg/L)也存在于非达霉素耐药的临床分离CD菌株中。RpoB的 Val1143Asp突变会影响CD的适应性和毒力。Val1143Asp、Val1143Gly 突变的实验室菌株与其亲本菌株R20291相比,整体生长变缓、竞争适应性下降且毒素A和B的产生均减少,在 CDI金黄地鼠模型中其毒力也降低。
由于这类耐药突变伴随着适应性降低,且非达霉素的窄谱活性对肠道微生物群影响较小,因此如果在治疗过程中出现耐药突变,共生的多种肠道微生物群可能有助于减轻突变带来的影响。
利福昔明和四环素类
利福昔明抑制细菌RNA聚合酶。细菌RNA聚合酶β亚基RpoB突变是产生利福霉素抗性的主要机制。这些突变会破坏利福霉素和RpoB的直接相互作用或改变RpoB上的利福霉素结合口袋(rifamycin-binding pocket)结构。
已发现CD中存在多处可造成耐药的RpoB突变,包括Ser488Tyr,Asp492Tyr,His502Asn/Tyr,Arg505Lys,Ser550Phe/Tyr。与其他菌株不同(例如脑膜炎奈瑟球菌和结核分枝杆菌),RpoB突变导致CD对利福霉素产生耐药性的同时不会产生体外和体内适应性代价。CD对利福霉素的耐药性发展迅速,有研究显示甚至在利福昔明用于CDI期间就可能出现耐药,导致临床效果不佳。
四环素类是靶向细菌30S核糖体的广谱抗菌药物,可阻止氨基酰-tRNA与mRNA结合从而抑制蛋白质翻译。与利福昔明相比,CD对替加环素的耐药率较低。CD通过转座子(例如Tn916、Tn5397和Tn4453)携带的各种tet基因(例如tetM、tetW、tetA(P)和tetB(P))编码的核糖体保护蛋白即延伸因子(elongationfactor),介导四环素类药物耐药性的产生。
随着对耐药性变迁和耐药机制的更好了解,将为抗菌药物合理应用,遏制耐药菌的产生和播散、新抗菌药以及新耐药菌快速检测试剂盒的研发提供理论基础。
- Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet, 2022, 399(10325): 629–655.
- Khoruts A, Staley C, Sadowsky MJ. Faecal microbiota transplantation for clostridioides difficile: mechanisms and pharmacology. Nat Rev Gastroenterol Hepatol, 2021, 18(1): 67–80.
- Boekhoud IM, Sidorov I, Nooij S, Harmanus C, Bos-Sanders IMJG, Viprey V, Spittal W, Clark E, Davies K, Freeman J, Kuijper EJ, Smits WK, COMBACTE-CDI Consortium. Haem is crucial for medium-dependent metronidazole resistance in clinical isolates of Clostridioides difficile. J Antimicrob Chemother, 2021, 76(7): 1731–1740.
- Zhao HL, Nickle DC, Zeng Z, Law PYT, Wilcox MH, Chen L, Peng Y, Meng J, Deng ZQ, Albright A, Zhong HZ, Xu X, Zhu SD, Shen JD, Blanchard RL, Dorr MB, Shaw PM, Li JH. Global landscape of clostridioides difficile phylogeography, antibiotic susceptibility, and toxin polymorphisms by post-hoc whole-genome sequencing from the MODIFY I/II studies. Infect Dis Ther, 2021, 10(2): 853–870.

